Por Davi J. Fontoura Solla, Residente em Neurocirugia – Hospital das Clínicas da Faculdade de Medicina da USP
Foi publicado na semana passada no The Lancet o estudo CRASH-3 1, um ensaio clínico multicêntrico, randomizado e controlado que avaliou o efeito da administração precoce (até 3h do trauma) do ácido tranexâmico em pacientes vítimas de traumatismo cranioencefálico (TCE). Atualmente, a melhor medida do quão “quente” é determinada notícia é a movimentação causada nas redes sociais. Não por acaso, recebi o CRASH-3 via WhatsApp encaminhado por alguns amigos e em grupos de médicos (particularmente da área de neurocirurgia, emergência e trauma).
O racional do ácido tranexâmico e dos estudos CRASH
O ácido tranexâmico, o transamin®, é um composto sintético inibidor da fibrinólise que foi estudado em diversas condições hemorrágicas com a hipótese de que reduziria o sangramento e, assim, resultaria em melhores desfechos. Além dos estudos com cirurgias eletivas e mulheres com hemorragia pós-parto (WOMAN trial 2), é muito conhecido o ensaio clínico CRASH-2 3, que avaliou o efeito do ácido tranexâmico em >20.000 vítimas de politraumatismo com choque hemorrágico ou alto risco de sangramento. Este estudo sugeriu redução da mortalidade, particularmente na administração precoce (em até 3h do trauma), o que seria compatível com o fenótipo de hiperfibrinólise observado na fase aguda da coagulopatia associada ao trauma. Inclusive, o CRASH-3 originalmente incluía pacientes até 8h após o trauma, porém foi modificado para limitar o recrutamento até 3h após o trauma 4.
Entretanto, o CRASH-2 havia incluído poucos pacientes com TCE (pouco mais de 200, apesar deste não ter sido um critério de exclusão) e apenas um outro estudo (pequeno, também com pouco mais de 200 pacientes 5) havia avaliado o efeito do ácido tranexâmico em pacientes com TCE. Assim, o CRASH-3 foi desenhado para responder a esta lacuna na literatura.
Quais foram os resultados do CRASH-3?
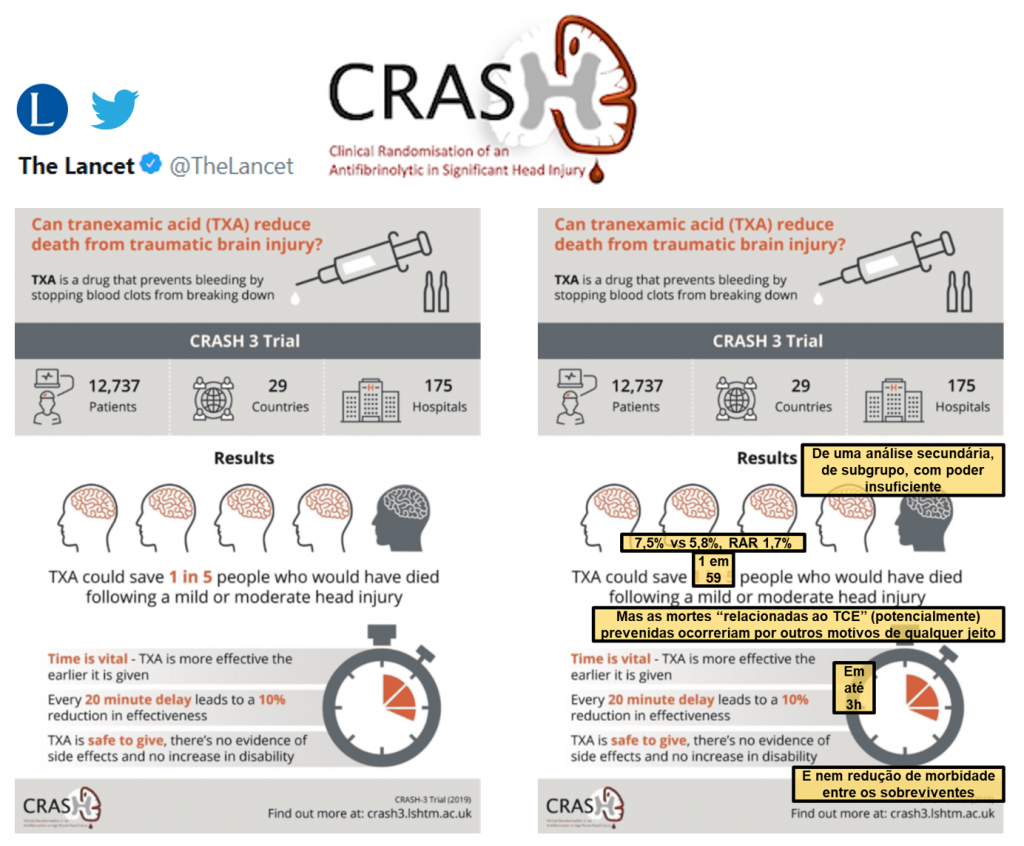
Dentre os mais de 9.000 pacientes randomizados em até 3h do trauma, o desfecho primário de óbito relacionado ao TCE foi semelhante entre os grupos ácido tranexâmico (18,5%) e placebo (19,8%), risco relativo (RR) 0,94 (IC 95% 0,86–1,02). Após exclusão dos pacientes com glasgow 3 ou pupilas midriáticas bilateralmente, o risco de óbito relacionado ao TCE foi de 12,5% vs 14,0% (RR 0,89, IC 95% 0,80–1,00). Por fim, análises de subgrupo sugeriram efetividade do ácido tranexâmico em TCE leve ou moderado (RR 0,78, IC 95% 0,64–0,95), mas não em TCE grave (RR 0,99, IC 95% 0,91–1,07). O risco de eventos adversos tromboembólicos foi semelhante (1,5% vs 1,3%, RR 1,13, IC 95% 0,80-1,59).
Baseado nestes resultados, alguns já sugerem mudança de conduta e inclusão do ácido tranexâmico no manejo de rotina de pacientes vítimas de TCE, quem sabe até com administração desde o pré-hospitalar. É mesmo o momento de atualizar nossa conduta? Como seriam as novas recomendações? Acreditamos que algumas questões ainda merecem melhor esclarecimento…
O desfecho primário
O desfecho primário no registro no clinicaltrials.gov era óbito intrahospitalar por qualquer causa (em até 28 dias; e a causa de óbito seria registrada). No plano de análise estatística (Statistical Analysis Plan, SAP), passou a ser “head injury death”, “as assessed and recorded by the responsible clinician” 5,6. O SAP é um documento que descreve nos mínimos detalhes (ainda mais que no protocolo do estudo) como será feita a análise estatística, já que esta é fundamental para os resultados e interpretação do ensaio clínico, e deve ser publicado antes da quebra do cegamento da randomização. Este foi o caso no CRASH-3 (a última versão do SAP foi publicado em Setembro de 2018), o que torna a mudança do desfecho primário ao longo do estudo um problema menor. Entretanto, lembremos que “head injury-related death as assessed by the responsible clinician” dá margem a subjetividade na definição do desfecho e erros de classificação são esperados, conforme reconhecido no SAP e na publicação final. Morte “relacionada ao TCE” é um desfecho menos “duro” / robusto que morte por qualquer causa, e mais difícil de adjudicar. Afinal, ainda que se possa argumentar que o efeito da intervenção poderia ser diluído por óbitos não-modificáveis pela intervenção, o que importa para o paciente é não morrer, independente da causa – e isso se torna ainda mais importante quando não temos tanta certeza assim do mecanismo de ação do ácido tranexâmico, como veremos mais abaixo.
Ainda no tópico do desfecho primário, há um fenômeno digno de nota no abstract: spin positivo da conclusão. Numa análise fria e rigorosa, o CRASH-3 foi um estudo negativo, em que o desfecho primário de óbito relacionado ao TCE não foi diferente entre os grupos (RR 0,94, IC 95% 0,86–1,02). Esta deveria ser a primeira e mais importante frase da conclusão, a qual foi inteiramente baseada nas análises de sensibilidade e de subgrupos (que até podem ser interessantes, mas não devem ser o foco). O spin positivo é um forte indicativo de tendenciosidade dos autores.
Qual a veracidade das análises de subgrupo?
Numa análise de subgrupo, estamos interessados em verificar se o efeito da intervenção é modificável conforme alguma característica dos pacientes. Ou seja, se há interação significativa entre esta característica e a intervenção. No SAP, estavam planejadas análises de subgrupo para o tempo trauma-intervenção, gravidade do TCE e idade.
Como observado, houve interação do efeito do ácido tranexâmico com a gravidade do TCE e a reatividade pupilar. A gravidade do TCE havia sido especificada no SAP para ser analisada em três grupos (leve, moderado ou grave) e não em dois grupos (leve/moderado ou grave) e a reatividade pupilar foi não pré-especificada. Ainda mais importante neste caso, o estudo não teve tamanho amostral e poder suficientes para as associações identificadas. Para identificar a diferença de 1,7% (7,5 – 5,8) observada nos pacientes com TCE leve/moderado com poder de 90%, o necessário seriam 9024 pacientes (no CRASH-3 haviam 5615 pacientes nesse perfil). Diferente do que muitos pensam, um menor poder estatístico está associado não só a maior chance de erro tipo II (risco de não encontrar uma associação verdadeira, ou risco de não rejeitar uma hipótese nula falsa), mas também a maior chance de erro tipo I (risco de encontrar uma associação falsa, ou rejeitar erroneamente uma hipótese nula verdadeira). Apesar de contra-intuitivo, isto pode ser demonstrado matematicamente de forma simples.
Ou seja, para a análise do subgrupo com TCE leve/moderado que tinha um poder de aprox. 70%, o risco de uma falsa descoberta (false discovery rate, definido como a proporção de erros tipo I) foi 22,2% (aprox. 33% maior que o ideal). Para a o subgrupo com ambas pupilas reativas, cujo poder foi de aprox. 60%, este risco de conclusões equivocadas pode ser calculado como 25% (aprox. 50% maior que o ideal).
Além de um maior risco de erro tipo I, efeitos de tratamento baseados em análises subdimensionadas tendem a ser inflados (maiores que o verdadeiro tamanho de efeito). Se a minha chance de encontrar determinada associação é baixa, quando a encontro, é provável que o acaso tenha influenciado aumentando o tamanho de efeito da associação.
Como interpretar as análises de subgrupo?
Desconsiderando o problema de poder acima, como deveríamos interpretar essas análises de subgrupo que sugerem um efeito nulo em TCE grave ou com alguma pupila não reativa (pragmaticamente, anisocoria ou midríase bilateral)? O tratamento seria fútil para este perfil de pacientes?
Um dos princípios básicos quanto a efeito de tratamento é que quanto maior o risco basal de um paciente (até o limite de “futilidade”), maior o benefício esperado decorrente do tratamento. Uma mesma redução do risco relativo (RRR) implicará em maior redução absoluta do risco (RAR) e um número necessário para tratar (NNT) mais favorável, menor (NNT = 1 / RAR).
Ainda que excluíssemos pacientes moribundos (a proporção de pacientes com glasgow abaixo de 6 ou reatividade pupilar alterada não passou de 20%, relativamente pouco para “diluir” tanto o efeito de tratamento), o subgrupo TCE grave é muito heterogêneo. Deveríamos ou não administrar ácido tranexâmico para um paciente com glasgow 6-8 e anisocórico? Nossas recomendações seriam rigorosas quanto à análise de subgrupo e interpretação de futilidade ou consideraríamos o “não aumento de efeito adverso” e baixo custo da medicação e seríamos mais complacentes na prescrição? Análises adicionais, post-hoc, do CRASH-3 seriam necessárias para entender melhor essas questões.
Mas, afinal, o ácido tranexâmico reduz mesmo a progressão hemorrágica das lesões?
Há um sub-estudo aninhado no CRASH-3 previsto para analisar 1.000 pacientes quanto à progressão hemorrágica das lesões na TC de crânio, o CRASH-3 Intracranial Bleeding Mechanistic Sub-Study (CRASH-3/IBMS) 6. Isto é mesmo necessário? Não é lógico e plausível pela farmacologia que o ácido tranexâmico tenha o efeito fisiopatológico de redução de sangramento? A verdade é que nossos modelos teóricos são frágeis frente à complexidade e dinamicidade dos processos biológicos na fisiologia normal e na patologia. (como diria um certo filósofo: não sabemos de nada, inocentes!). A literatura médica está repleta de exemplos de tratamentos que foram desenhados sob um racional fisiológico que se mostrou falso e cujo mecanismo de ação veio a se mostrar outro. Aliás, muito, se não a maior parte, do que sabemos sobre fisiopatologia e tratamento, decorreu de observações a posteriori, e não de modelos a priori (diferente da falsa impressão linear transmitida pelos livros).
Nos dois maiores estudos prévios com ácido tranexâmico, o CRASH-2 e o WOMAN, não houve redução da necessidade de transfusão ou do número de unidades transfundidas. Inclusive, até sub-estudos do CRASH-2 chegaram a aventar outros mecanismos de ação para o ácido tranexâmico, como redução da atividade pró-inflamatória da plasmina 7. Enfim, é plausível e possível que o ácido tranexâmico reduza sangramento? Sim. Temos tanta certeza de que este é seu mecanismo de ação para eventual melhora dos desfechos no trauma e no TCE? Não.
Os resultados do CRASH-3/IBMS ainda não estão disponíveis.
Em resumo…
Ainda que seja compreensível o entusiasmo com um dos únicos estudos possivelmente positivos para uma intervenção farmacológica na fase aguda do TCE, há muitas questões a serem esclarecidas.
- A efetividade só foi formalmente demonstrada em análises de sensibilidade, após ajuste estatístico ou em análises de subgrupo;
- As análises de subgrupo tinham poder aquém do desejado;
- Ainda precisamos avançar na interpretação do efeito no TCE grave;
- O NNT seria, na melhor das hipóteses, moderado (~60-70);
- Apesar de barato do ponto de vista individual, o custo para o sistema de saúde pode ser alto numa situação de uso indiscriminado, dada a incidência de TCE;
- Atingir a meta de 3h enquanto janela para administração do ácido tranexâmico não é tão fácil na realidade da maioria da população dos países de baixa e média renda (onde ocorre a maioria dos TCE).
Pessoalmente, acredito (e isto é diferente da evidência) que ainda iremos refinar este ou outros estudos com ácido tranexâmico e discriminar melhor os pacientes que se beneficiam de fato (por exemplo, com aplicação de escores prognósticos que estimem o risco de progressão hemorrágica de lesões traumáticas – o que, por coincidência, é o tema do projeto do meu futuro doutorado).
Administrarmos ácido tranexâmico de forma quase indiscriminada, neste momento, não irá contribuir com este refinamento, pelo contrário. Talvez seja prudente contermos um pouco o entusiasmo… um bom “ABC” ainda é o melhor que podemos oferecer aos nossos pacientes vítimas de TCE.
** Contribuíram com essa análise discussões com o Dr. Wellingson Paiva (Supervisão do Pronto-Socorro da Neurocirurgia do HCFMUSP), Dr. Angelos Kolias (Divisão de Neurocirurgia, Universidade de Cambridge, UK) e Dr. Andres Rubiano (Instituto de Neurociências, Universidade El Bosque, Colômbia).
Referências
1 Effects of tranexamic acid on death, disability, vascular occlusive events and other morbidities in patients with acute traumatic brain injury (CRASH-3): a randomised, placebo-controlled trial. Lancet 2019; published online Oct. DOI:10.1016/S0140-6736(19)32233-0.